Chuyên Đề Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
Các dạng bài tập Bảng tuần hoàn những nguyên tố hóa học gồm đáp án chi tiết
Với các dạng bài tập Bảng tuần hoàn những nguyên tố hóa học gồm đáp án chi tiết Hoá học tập lớp 10 tổng hợp những dạng bài xích tập, trên 200 bài bác tập trắc nghiệm bao gồm lời giải cụ thể với đầy đủ cách thức giải, ví dụ như minh họa sẽ giúp học sinh ôn tập, biết phương pháp làm dạng bài bác tập Bảng tuần hoàn những nguyên tố chất hóa học từ đó đạt điểm trên cao trong bài thi môn Hoá học tập lớp 10.
Bạn đang xem: Chuyên đề bảng tuần hoàn các nguyên tố hóa học

Tổng hợp kim chỉ nan chương Bảng tuần hoàn các nguyên tố hóa học
Phương pháp giải những dạng bài bác tập chương Bảng tuần hoàn những nguyên tố hóa học
Bài tập trắc nghiệm
Xác định nguyên tố thuộc 2 đội A tiếp tục trong Bảng HTTH
A. Cách thức & Ví dụ
Lý thuyết và phương pháp giải
Cần nhớ:
- tổng cộng hiệu nguyên tử 4 T A - ZB = 8.
- nếu ZT > 32 thì ta bắt buộc xét cả 3 trường hợp:
+ A là H. + A và B bí quyết nhau 8 1-1 vị.
+ A cùng B bí quyết nhau 18 solo vị.
Do nhị nguyên tố thuộc cùng một đội nhóm nên tính chất giống như nhau, vì chưng vậy với những bài bác toán liên quan đến các thành phần hỗn hợp phản ứng ta núm hỗn hợp bằng một công thức chung, tiếp nối tìm M− rồi chọn hau nguyên tố thuộc hau chu kì của cùng nhóm sao cho:
MA M− B (MA B)
Ví dụ minh họa
Ví dụ 1: A cùng B là nhì nguyên tố ngơi nghỉ cùng một tổ và thuộc hai chu kì thường xuyên trong bảng tuần hoàn. Tổng số proton trong nhì hạt nhân nguyên tử của A cùng B bằng 32. Hãy viết thông số kỹ thuật electron của A, B và của các ion mà A với B rất có thể tạo thành.Hướng dẫn:
Theo bài xích ra, tổng cộng proton trong hai hạt nhân nguyên tử của A cùng B bằng 32 yêu cầu ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, đội IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 cùng B2+: 1s22s22p63s23p6.
Trường phù hợp 2: ZB - ZA = 18. Ta kiếm được ZA = 7; D = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, team VIIB).
Trường vừa lòng này A, B không cùng nhóm nên không thỏa mãn.
Ví dụ 2. đến 8,8 gam một tất cả hổn hợp hai kim loại nằm ở hai chu kì thường xuyên nhau với thuộc đội IIIA, công dụng với HCl dư thì nhận được 6,72 lít khí hidro (đktc). Phụ thuộc bảng tuần hoàn cho biết tên hai sắt kẽm kim loại đó.
Hướng dẫn:
Kí hiệu hai kim loại nhóm IIIA là M, nguyên tử khối vừa đủ là M−
Phương trình hóa học bao gồm dạng: 2M + HCl → 2MCl2 + 3H2
nH2 = 6,72/22,4 = 0,3 (mol)
nM = 2/3 nH2 = 0,2 (mol)
theo đầu bài: M− .0,2 = 8,8 → M− = 44
hai sắt kẽm kim loại thuộc nhị chu kì liên tiếp, một sắt kẽm kim loại có nguyên tử khối nhỏ dại hơn 44 với một kim loại có nguyên tử khối lơn rộng 44.
Dựa vào bảng tuần hoàn, hai kim loại đó là:
Al (M = 27 44).
Ví dụ 3: hòa tan 20,2 gam tất cả hổn hợp hai sắt kẽm kim loại nằm ở hai chu kì tiếp tục thuộc nhóm IA vào bảng tuần hoàn chức năng với nước chiếm được 6,72 lít khí (đktc) cùng dung dịch A. Xác định tên và trọng lượng hai kim loại.
Hướng dẫn:
Gọi R là kí hiệu tầm thường của hai kim loại nhóm IA, R cũng chính là nguyên tử khối trung bình của hai kim loại.
2R + 2H2O → 2ROH + H2 ↑
0,6 0,3
nH2 = 6,72/22,4 = 0,3 (mol)
R = 20,2/0,6 = 33,67
Vì hai sắt kẽm kim loại thuộc nhị chu kì tiếp tục nên một kim loại phải có nguyên tử khối nhỏ dại hơn 33,67 cùng kim loại còn sót lại có nguyên tử khối lớn hơn 33,67.
Vậy ta có: R1 = 23 (Na) 2 = 39 (K)
Dựa vào bảng tuần trả hai sắt kẽm kim loại đó là Na, K
2Na + 2H2O → 2NaOH + H2 ↑
x x/2
2K + 2H2O → 2KOH + H2 ↑
y y/2
Ta có hệ phương trình:
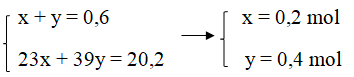
mNa = 23.0,2 = 4,6 (gam)
mK = 39.0,4 = 15,6 (gam)
B. Bài tập trắc nghiệm
Câu 1. Hòa tan 5,6 gam tất cả hổn hợp hai sắt kẽm kim loại X với Y thuộc đội IA vào 174,7 gam nước chiếm được 180 gam dung dịch A. Khẳng định tên kim loại X và Y. Biết bọn chúng ở nhì chu kì liên tiếp.
Lời giải:
Đáp án:
Đặt M− là trọng lượng nguyên tử vừa đủ của nhì kim loại.
2M− + 2H2O → 2M−OH + H2 (1)
0,3 0,3 0,15
Áp dụng định cơ chế bảo toàn khối lượng:
mhh + mH2O = mddA + mH2 → mH2 = 5,6 + 174,7 - 180 = 0,3 (gam)
→nH2 = (0,3 )/2 = 0,15 (mol)
Theo (1): nM− = 0,3 mol → M− = 5,6/0,3 = 18,67
Vì hai kim loại ở nhì chu kì liên tục nên X là Li (MX = 7), Y là mãng cầu ( MY = 23)
Câu 2. Biết rằng X, Y là nhị nguyên tố thuộc và một phân nhóm thiết yếu ở nhị chu kì liên tiếp trong bảng tuần hoàn những nguyên tố, có tổng số proton trong hai hạt nhân là 32. Hãy viết cấu hình electron của nguyên tử X với Y.
Lời giải:
Đáp án:
Gọi ZX, ZY theo thứ tự là số proton của nguyền tố X với Y.
Theo đề bài, ta có: ZX + ZY = 32 (1)
Vì X, Y ở cùng phân nhóm chính và ở hai chu kì tiếp nối nhau buộc phải số proton của nhúng khác biệt hoặc là 8; 18, 32 1-1 vị. Cho nên vì vậy xét 3 trường hợp sau. đưa sử ZY > ZX
Trường thích hợp 1: ZY - ZX = 8 (2)
Giải (1) và (2) ⇒ ZX = 12 ; ZY = 20
Cấu hình electron của (X): ls22s22p63s2
cấu hình electron của (Y): ls22s22p63s23p64s2
Phù hợp với đề bài xích (2 chu kì liên tục và sống phân team chính) nên nhận.
Trường hợp 2:ZY - ZX = 18 (3)
Giải (1) và (3) ⇒ ZX = 7 ; ZY = 25
Vậy: cấu hình electron của..(X): ls22s22p3 trực thuộc chu kì 2
Cấu hình electron của (Y): ls22s22p63s23p64s23d5: trực thuộc chu kì 4. Vậy laoij trường phù hợp này bởi không vừa lòng điều khiếu nại đề bài.
Trường đúng theo 3:ZY - ZX = 32 (3)
Giải (1) với (4) ⇒ ZY= 32 ; ZX = 0 (loại)
Vậy dấn trường đúng theo 1.
Câu 3. Hỗn thích hợp A có 2 kim loại X, Y thuộc nhì chu kì liên tục ở phân team IIA. Mang đến 2,64 gam A tác dụng hết với hỗn hợp H2SO4 loãng nhận được 2,016 khí (đktc). Xác định X, Y.
Lời giải:
Đáp án:
Thay thay hỗn hợp kim loại bởi một kim loại tương tự M−.
Số mol H2 = 0,09 (mol)M− + H2SO4 → M ̅SO4 + H2
(mol) 0,09 ← 0,09
⇒ M− = 2,64/0,09 = 29,33
⇒ Mg = 24 3 (dư), chiếm được 18,655 gam kết tủa. Tra cứu 2 kim loại kiềm.
Lời giải:
Đáp án:
Ta có: nNaCl = 18,655/143,5=0,13 mol
M−Cl + AgNO3 → M−NO3 + AgCl
0,13 mol 0,13 mol
⇒ (M− + 35,5).0,13 = 6,645 → M− = 15,62
Mà 2 kim loại kiềm thuộc nhì chu kì tiếp nối nhau → Li (7) với Na(23)
Câu 5. A, B là 2 sắt kẽm kim loại nằm ở nhì chu kì tiếp tục thuộc team IIA. Cho 4,4 gam một láo hợp tất cả A và B chức năng với HCl 1M (dư) nhận được 3,36 lít khí (đktc).
a) Viết các phương trình làm phản ứng và xác định tên hai sắt kẽm kim loại trên.
b) Tính thể tích dung dịch HCl vẫn dùng, hiểu được HCl cần sử dụng dư 25% đối với lượng bắt buộc thiết.
Lời giải:
Đáp án:
a) Gọi cách làm chung của hai kim loại là M
M + 2HCl → MCl2 + H2
nM = nH2 = 0,15
Ta có: MA = 4,4 → M = 4,4/0,15 = 29,33
A và B là 2 sắt kẽm kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IIA cần A là Mg và B là Ca.
b) nHCl = 0,15.2= 0,3 mol ⇒ VHCl = 0,3/1 =0,3 lít = 300 ml.
VHCl đã dùng = 300 + 25%.300 = 375 ml.
Câu 6. mang lại 10,2 gam hỗn hợp hai sắt kẽm kim loại thuộc nhóm IA với ở nhị chu kì liên tục trong bảng tuần hoàn, tác dụng với H2O dư nhận được 5,6 lít khí H2 (đktc). Khẳng định tên của hai sắt kẽm kim loại đem dùng.
Lời giải:
Đáp án:
Gọi sắt kẽm kim loại thuộc nhì chu kì liên tiếp và thuộc đội IA là: X với Y (MX Y).
Gọi sắt kẽm kim loại chung của hai sắt kẽm kim loại này là : A−
2A− + 2H2O → 2A−OH + H2 ↑ (1)
(mol) 0, 5← 0, 25
Ta có: nH2 = 5,6/22,4 = 0,25 (mol). Tự (1) ⇒ mãng cầu = 0, 5(mol)
MA = (10,2)/0,5 = 20, 4 ⇒ MX A = 20, 4 Y
Vậy X là Li (M = 7) cùng Y là mãng cầu ( M = 23)
Câu 7. mang đến 6,6 gam một các thành phần hỗn hợp hai kim loại thuộc nhóm IIA và thuộc nhì chu kì liên tục nhau chức năng với hỗn hợp HCl dư nhận được 5,04 lít khí H2 (đktc). Hãy xác minh hai kim loại trên.
Lời giải:
Đáp án:
Gọi kim loại đầu tiên là A và kim loại thứ nhì là B, đưa sử MA B.
Vì A, B phần lớn thuộc team IIA nên đều phải sở hữu hóa trị II
⇒ Gọi kim loại chung cho hai sắt kẽm kim loại trên là M− (Với MA M− B)
Ta có: nH2 = 5,04/22,4 = 0,225 (mol)
Phản ứng: M− + 2HCl → M−Cl2 + H2 ↑ (1)
mol 0,225 ← 0,225
Từ (1) ⇒ nM− = M− × 0,225 = 6,6 ⇒ M− = 29,33
Dựa vào bảng tuần hoàn ⇒ Cặp nghiệm tuyệt nhất là: A(Mg) và B(Ca).
Câu 8. X cùng Y là nhị nguyền tố thuộc nhị chu kì thường xuyên nhau và thuộc thuộc một tổ A, trong số đó X có điện tích hạt nhân nhỏ tuổi hơn Y. Tổng thể proton trong phân tử nhân nguyên tử của X cùng Y là 22. Xác định hai nhân tố X, Y.
Lời giải:
Đáp án:
Theo đề bài, ta có: ZX + ZY = 22 (1)
Nếu X, Y thuộc nhì chu kì nhỏ tuổi thì (ZX Y): ZY = ZX + 8 (2)
Từ (1) và (2) ⇒ ZX = 7; ZY = 15.
Vậy X là N, Y là P.
Nếu X ở trong chu kì nhỏ tuổi và Y thuộc chu kì to thì: ZY = ZX + 18 (3)
Từ (1) với (3) ⇒ ZX = 2; ZY = 20 (loại vày không thảo mãn đề bài).
Nếu X, Y thuộc nhị chu kì lớn: ZY = ZX + 32 (4)
Từ (1) và (4) ⇒ ZX A B + Trường đúng theo 1: nhì nguyên tố thuộc thuộc chu kì ⇒ ZB = ZA + 1
+ Trường thích hợp 2: nhì nguyên tố khác chu kì:
- từ tổng Z của nhị nguyên tố A với B → Z− = Z/2 → ZA Z− B
- Từ đó giới hạn các khả năng hoàn toàn có thể xảy ra đối với A (hay B) đồng thời phối kết hợp giả thiết để lựa chọn nghiệm phù hợp.
Ví dụ minh họa
Ví dụ 1. Hai nhân tố X cùng Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số năng lượng điện hạt nhân bằng 25.
a)Hãy viết thông số kỹ thuật electron của nguyên tử X, Y.
b)Xác xác định trí của X, Y trong bảng tuần hoàn.
c)Viết công thức hợp chất oxit tối đa của X với Y.
Hướng dẫn:
a) Viết cấu hình electron
Vì X và Y đứng sau đó khác nhau trong và một chu kì buộc phải hạt nhân của chúng chỉ khác nhau 1 đơn vị.
Giả sử ZX Y ⇒ ZY = ZX + 1
Theo đề bài, ta có: ZX + ZY = ZX + ZX + 1 = 25
⇒ ZX = 12 cùng ZY = 13
Cấu hình electron cùa X: ls22s22p63s2: Magie (Mg)
Cấu hình electron của Y: ls22s22p63s23p1: Nhôm (Al)
b) Vị trí
- Đối với nguyên tử X:
+ X thuộc chu kì 3 vì tất cả 3 lớp electron.
+ X trực thuộc phần team IIA vì có 2 electron ở lớp ngoài cùng
⇒ X là kim loại.
+ X ở trong ô lắp thêm 12 bởi (Z = 12)
- Đối cùng với nguyên tử Y;
+ Y trực thuộc chu kì 3 vì gồm 3 electron.
+ Y nằm trong phân team IIIA vì có 3 electron ở lớp bên ngoài cùng
⇒ Y là kim loại.
c) phương pháp hợp chất oxit tối đa của X, Y thứu tự là: MgO cùng Al2O3
Ví dụ 2. nhị nguyên tố A và B sinh sống hai team A liên tục trong bảng tuần hoàn, B thuộc đội VA, sinh hoạt trạng thái đối kháng chất A, B không phản ứng với nhau. Tổng cộng proton trong phân tử nhân nguyên tử của A và B là 23. Viết cấu hình electron nguyên tử của A, B.
Hướng dẫn:
A với B ở hai đội A thường xuyên trong bảng tuần hoàn, B thuộc đội VA
⇒ A thuộc nhóm IVA hoặc đội VIA.
Theo bài:
⇒ A, B thuộc những chu kì nhỏ dại (chu kỳ 2 và chu kỳ luân hồi 3).
Mặt khác, A và B bắt buộc cùng chu kỳ luân hồi vì nhị nguyên tố nằm trong hai nhóm A tiếp đến trong một chu kỳ hơn nhát nhau 1 proton, nghĩa là nghỉ ngơi ô số 11 và 12 (tổng số proton bằng 23), không thuộc những nhóm IV cùng V giỏi V với VI.
TH1: B thuộc chu kỳ luân hồi 2 ⇒ ZB = 7 (nitơ).
Vậy ZA = 23 - 7 = 16 (lưu huỳnh).
Xem thêm: Review Viên Uống Rau Củ Dhc Có Tốt Không ? 10 Điều Cần Biết Review Viên Uống Rau Củ Dhc Có Tốt Không
Trường thích hợp này thỏa mãn nhu cầu vì ở trạng thái 1-1 chất nitơ ko phản ứng với lưu lại huỳnh.
TH2: B thuộc chu kỳ luân hồi 3 ⇒ ZB = 15 (phopho).
Vậy ZA = 23 - 15 = 8 (oxi).
Trường phù hợp này không thỏa mãn nhu cầu vì sinh hoạt trạng thái 1-1 chất oxi làm phản ứng cùng với phopho.
⇒ thông số kỹ thuật electron của A cùng B là: A: 1s22s22p63s23p4 và B: 1s22s22p3
B. Bài bác tập trắc nghiệm
Câu 1. Hai yếu tố A và B ở nhì phân đội chính liên tiếp trong bảng tuần hoàn các nguyên tố hốa học. Tống số hiệu nguyên tử của A với B là 31. Xác định số hiệu nguyên tử, viết thông số kỹ thuật electron của những nguyên tử của A cùng B. Nêu đặc điểm đặc trưng của mỗi nguyên tố. Viết thông số kỹ thuật electron của những ion tạo ra thành
Lời giải:
Đáp án:
Giả sử yếu tố A gồm số hiệu nguyên tử lớn hơn nguyên tố B.
Ta có: page authority + PB = 31; có những trường hợp có thể xảy ra A cùng B thuộc nhì phân nhóm chính liên tiếp (nhóm A liên tiếp):
TH1. A, B thuộc cùng một chu kì: PB – pa = 1 ⇒ page authority = 15; PB = 16.
Cấu hình electron của các nguyên tử A và B thứu tự là: ls22s22p63s23p3 và ls22s22p63s23p4.
A nằm trong ô 15, chu kì 3, team VA
B thuộc ô 16, chu kì 3, đội VIA.
Cả A và B đa số là phi kim nên đều phải sở hữu tính oxi hóa:
A + 3e → A3-B + 2e → B2-
TH2. A, B không thuộc và một chu kì và A thuộc team sau đội của B (PA > PB): PB - page authority = 7 ⇒ pa = 12; PB = 19.
Cấu hình electron thuộc các nguyên tử A cùng B theo lần lượt là: ls22s22p63s2 cùng ls22s22p63s23p64s1.
A nằm trong ô 12, chu kì 3, team IIA
B nằm trong ô 19, chu kì 4, nhóm IA, A với B số đông là kim loại:
A → A+ + eB → B2+ + 2e
TH3. A, B không thuộc và một chu kì cùng A thuộc team trước của B (PA B)
PB - pa = 9 ⇒ pa = 11; PB = 20.
Cấu hình electron của những nguyên tố A và B theo lần lượt là: ls22s22p63s1 và ls22s22p63s23p64s2.
A trực thuộc ô 11, chu kì 3, team IA
B nằm trong ô 19, chu kì 4, team IIA. A cùng B những là kim loại:
A → A+ + eB → B2+ + 2e
Câu 2. Hai nhân tố A, B đứng sau đó nhau trong và một chu kì của bảng tuần hoàn bao gồm tổng số đơn vị chức năng điện tích phân tử nhân là 25.Viết thông số kỹ thuật electron để khẳng định hai yếu tố A cùng B ở trong chu kì nào, đội nào.
Lời giải:
Đáp án:
Gọi số năng lượng điện hạt nhân của nguyên tố A cùng B thứu tự là ZA, ZB.
Giả sử ZA B.
Theo đề bài, số năng lượng điện hạt nhân của thành phần B là ZB = ZA + 1
Nên: ZA + ZB = 2ZA + 1 = 25 → ZA = 12, ZB = 13
Cấu hình nguyên tử:
A (Z = 12): 1s22s22p63s2 thành phần A thuộc đội IIA, chu kì 3.
B (Z = 13): 1s22s22p63s23p1 yếu tắc B thuộc team IIIA, chu kì 3.
A và B thuộc thuộc chu kì.
Câu 3. X, Y, Z là ba kim loại liên tiếp nhau trong một chu kì. Toàn bô khối của chúng là 74. Khẳng định X, Y, Z.
Lời giải:
Đáp án:
Vì bố kim loại thường xuyên nhau vào một chu kì đề nghị số proton của X, Y, Z theo thứ tự là p, phường + 1, p. + 2.
Tổng số proton của sắt kẽm kim loại là: p. + (p + 1) + (p + 2) = 3p + 3.
Ta có: 3p + 3 + (n1 + n2 + n3)= 74
3p + 3 ≤ n1 + n2 + n3 ≤ 1,5(3p + 3) ⇒ 8,8 ≤ p. ≤ 11,3
| p | 9 | 10 | 11 |
| Nguyên tố | F | Ar | Na |
Vì X, Y, Z là kim loại, phải ta nhận p = 11 là sắt kẽm kim loại Na.
Ba kim loại liên tiếp trong một chu kì bắt buộc X, Y, Z là Na, Mg, Al.
Câu 4. Phân tử X2Y bao gồm tổng số proton là 23. Biết X, Y sinh sống hai team (A) tiếp tục trong cùng một chu kì. Dựa vào thông số kỹ thuật electron những nguyên tử X, Y. Tìm cách làm phân tử và hotline tên hợp hóa học X2Y.
Lời giải:
Đáp án:
Đặt số proton của X, Y là ZX với ZY Ta có: 2ZX + ZY = 23 (*)
+ trường hợp X trước Y thì ZY = ZX + 1
(*) ⇒ 2ZX + ZX + 1 = 23 ⇒ ZX = 22/3 = 7,3 (vô lí)
+ trường hợp Y trước X thì ZX = ZY + 1
(*) ⇒ 2(ZY + 1) + ZY = 23 ⇔ 3ZY = 21
Vậy:ZY = 7 ⇒ Y là N
ZX = 8 ⇒ X là O
Công thức X2Y là NO2.
Câu 5. X với Y là nhì nguyên tố ở trong hai nhóm A sau đó nhau trong bảng tuần hoàn, sinh sống trạng thái solo chất X và Y phản ứng được với nhau. Tổng thể proton trong hạt nhân nguyên tử của X và Y là 23. Hiểu được X đứng sau Y vào bảng tuần hoàn. Xác minh tên nhân tố X.
Lời giải:
Đáp án:
Vì đề xuất x cùng Y là những nguyên tố ở trong chu kì nhỏ.
X cùng Y là 2 nguyên tố ở trong 2 team kế tiếp
⇒ Số proton của X với Y hơn nhát nhau 1 hoặc 7 hoặc 9.
Ta xét từng ngôi trường hợp:
TH1: ví như pX - pY = 1 ⇒ pX = 12(Mg), pY = 11(Na)
Ở trạng thái đơn chất nhì nguyên tố này không phản ứng với nhau(loại).
TH2: nếu như pX - pY = 7 ⇒ pX = 15(P), pY = 8(O)
Ở trạng thái solo chất nhị nguyên tố này bội phản ứng được với nhau (nhận).
TH3: ví như pX - pY = 9 ⇒ pX = 16(S), pY = 7(N)
Ở trạng thái đối chọi chất nhì nguyên tố này không phản ứng cùng với nhau(loại).
Vậy X là P.
Xác định nguyên tố trải qua nguyên tử khối
A. Phương pháp & Ví dụ
Lý thuyết và phương pháp giải
Muốn khẳng định tên yếu tắc cần tìm kiếm được M phụ thuộc vào thành phần tỷ lệ nguyên tố M trong hỗn hợp; nhờ vào các làm phản ứng hóa học, các tính chất của M.….
Ví dụ minh họa
Ví dụ 1. mang lại 10 gam kim loại A (thuộc đội IIA) tác dụng với nước, nhận được 6,11 lit khí hiđro (đo ngơi nghỉ 25oC cùng 1 atm).
a. Hãy xác định tên của sắt kẽm kim loại M đang dùng.
b. Mang lại 4 gam kim loại A vào ly đựng 2,5lit hỗn hợp HCl 0,06M thu được hỗn hợp B.
Hướng dẫn:
A + 2H2O → A(OH)2 + H2
a a
Số mol khí H2 = 0,25 (mol) ⇒ a = 0,25
Ta có: MA = 10/0,25 = 40 (Ca).
b. Số mol Ca = 4/40 = 0,1 mol. Những phương trình bội nghịch ứng:
Ca + 2HCl → CaCl2 + H2
(mol): 0,075 0,15 0,075
Ca + 2H2O → Ca(OH)2 + H2
(mol): 0,025 0,025
Dung dịch B gồm: CaCl2 = 0,075 mol cùng Ca(OH)2 = 0,025 mol.
Ví dụ 2. Oxit tối đa của một nguyên tố ứng với cách làm RO3. Hợp hóa học của nó với hidro gồm 5,88% H về khối lượng. Xác minh R.
Hướng dẫn:
Oxit tối đa là RO3 → R thuộc team VIA.
Hợp hóa học với hidro gồm dạng RH2.
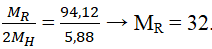
Đó là nguyên tố diêm sinh (S).
Ví dụ 3: Nguyên tử của thành phần C có thông số kỹ thuật electron phần ngoài cùng là ns2np4. Vào hợp hóa học khí của X cùng với hidro, X chỉ chiếm 94,12% khối lượng. Phần trăm trọng lượng của nhân tố X vào oxit cao nhất là:
A.50,00%B.27,27%C.60,00%D.40,00%
Hướng dẫn:
X: ns2np4 → X thuộc đội IVA → hợp hóa học khí cùng với H là XH2 → oxit tối đa là XO3.
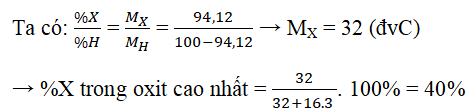
B. Bài xích tập trắc nghiệm
Câu 1: Oxit tối đa của một yếu tố ứng với bí quyết R2O5. Hợp chất của nó cùng với hidro là 1 chất tất cả thành phần không thay đổi với R chỉ chiếm 82,35% với H chỉ chiếm 17,65% về khối lượng. Tìm nguyên tố R.
Lời giải:
Đáp án:
Nguyên tố có oxit cao nhất là R2O5 → R thuộc nhóm VA.
→ Hợp chất với hidro: RH3
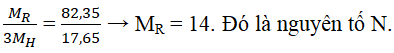
Câu 2: Oxit cao nhất của thành phần R tất cả dạng R2O7. Sản phầm khí của R cùng với hidro đựng 2,74% hidro về khối lượng. Xác định nguyên tử khối của R.
Lời giải:
Đáp án:
Oxit cao nhất của yếu tắc R có công thức R2O7.
→ cách làm hợp hóa học khí với hidro tất cả dạng RH theo đề:
%H = 1/(R+1) . 100% = 2,74%
Giải ra ta có: R = 35,5 (clo). Cl
→ phương pháp phân tử của oxit là Cl2O7
Công thức hợp hóa học khí cùng với hidro là HCl.
Câu 3: Cho 3 gam tất cả hổn hợp gồm sắt kẽm kim loại Na cùng một kim loại kiềm X chức năng hết cùng với nước thu được dung dịch A. Để th-nc dung dịch A phải dùng dung dịch không 200ml hỗn hợp HCl 1M.
a.Xác định sắt kẽm kim loại kiềm X.
b.Tính khối lượng mỗi sắt kẽm kim loại trong lếu hợp.
Lời giải:
Đáp án:
a) núm hỗn hợp tất cả Na với X bởi M− (M− là nguyên tử khối vừa đủ của Na cùng X)
Ta có: 2M− + 2H2O → 2M−OH + H2
M−OH + HCl → M−Cl + H2O
→ nM− = nMOH = nHCl = 0,2 mol
→ M− = 3/0,2 = 15 > MNa → MX b) điện thoại tư vấn a,b thứu tự là số mol của Na và Li tất cả trong 3 gam láo lếu hợp
Ta tất cả : 23a + 7b = 3 cùng a + b = 0,2
→ a = b = 0,1 → mNa = 2,3 g; mLi = 0,7g
Câu 4: Nguyên tử Y tất cả hóa trị tối đa với oxi cấp 3 lần hóa trị trong hợp chất khí cùng với hidro. điện thoại tư vấn X là cách làm hợp chất oxit cao nhất, Z là bí quyết hợp hóa học khí với hidro của Y. Tỉ khối khá của X đối với Z là 2,353. Khẳng định nguyên tố Y.
Lời giải:
Đáp án:
Gọi hóa trị tối đa với H là nH và với oxi là nO.
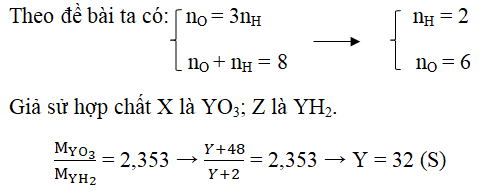
Câu 5: Muối X được chế tạo ra thành bởi một kim loại hóa trị 2 và phi kim hóa trị 1. Hài hòa 4,44 gam A vào H2O rồi chia làm hai phần bởi nhau:
-Cho phần 1 tác dụng với dung dịch AgNO3 dư chiếm được 5,74g kết tủa.
-Cho phần 2 chức năng với hỗn hợp Na2CO3 dư chiếm được 2g kết tủa.
Tìm phương pháp muối X
Lời giải:
Đáp án:
gọi A là nguyên tử khối (đvC) của sắt kẽm kim loại A cùng B là nguyên tử khối (đvC) của phi kim B.
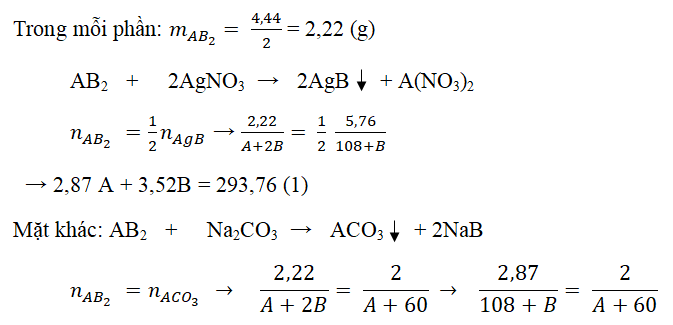
→ 2,87A – 2B = 43,8 (2)
Từ (1) cùng (2) → B = 35,5; A = 40
Vậy A là Ca, B là Cl. Cách làm muối X: CaCl2.
Câu 6: M là sắt kẽm kim loại thuộc team IIA. Phối hợp hết 10,8 gam hỗn hợp kim loại muối hạt cacbonat của chính nó trong hỗn hợp HCl, chiếm được 4,48 lít các thành phần hỗn hợp khí A (đktc). Tỷ khối của A đối với khí hidro là 11,5.
1.Tìm sắt kẽm kim loại M
2.Tính % thể tích các khí trong A.
Lời giải:
Đáp án:
Gọi số mol các chất trong các thành phần hỗn hợp đầu: M = a mol; MCO3 = b mol.
M + 2HCl → MCl2 + H2 (1)
(mol): a a
MCO3 + 2HCl → MCl2 + CO2 + H2O (2)
(mol): b b
Số mol A = 4,48/22,4 = 0,2 bắt buộc a + b = 0,2 (3)
MA = 11,5 x 2 = 23 đề nghị (2a + 44b)/(a + b) = 23 tuyệt 2a + 44b = 4,6 (4)
Theo bài: Ma + (M + 60)b = 10,8 (5)
Từ (3), (4), (5) ta tra cứu được: a = 0,1 mol, b = 0,1 mol, M = 24 (Mg)
% VH2 = 50%; VCO2 = 50%
Câu 7: gồm 5,56 gam các thành phần hỗn hợp A có Fe và kim loại M (hóa trị n). Phân chia A có tác dụng hai phần bằng nhau:
Phần 1: kết hợp hết trong dung dịch HCl được 1,568 lit khí H2.
Phần 2: kết hợp hết trong hỗn hợp H2SO4 sệt nóng chiếm được 2,016 lit khí SO2.
Viết các phương trình bội phản ứng và khẳng định tên sắt kẽm kim loại M. Các khí đo nghỉ ngơi đktc.
Lời giải:
Đáp án:
Phần 1:
Fe + 2HCl → FeCl2 + H2
(mol): x x
2M + 2nHCl → 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 đề nghị x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4(đặc) → Fe2(SO4)3 + 3SO2 + 6H2O
x 1,5x
2M + 2nH2SO4(đặc) → M2(SO4)n + nSO2 + 2nH2O
y 0,5nx
Số mol SO2 = 0,09 phải 1,5x + 0,5ny = 0,09 ⇒ x = 0,04 với ny = 0,06.
Mặt khác: 56x + My = 2,78
⇒ My = 0,54 ⇒ M = 9n.
Lần lượt xét n =1,2,3 ta được đáp án tương xứng là n = 3 ⇒ M = 27 (Al)
Câu 8: Hòa tan hết a gam oxit sắt kẽm kim loại M (thuộc nhóm IIA) bởi một số lượng vừa đủ dung dịch H2SO4 17,5% thu được dung dịch muối tất cả nồng độ 20%.Xác định phương pháp oxit sắt kẽm kim loại M.
 Bán máy quay ly tâm sản xuất hàng rào, bán khuôn hàng rào bê tông ly tâm, khuôn hàng rào xi măng thông thường, khuôn con tiện lan can, khuôn con tiện cầu thang xi măng giả gỗ, khuôn cây hương, khuôn con sơn kèo chữ a, khuôn đầu cột, đầu dầm, khuôn mâ
Bán máy quay ly tâm sản xuất hàng rào, bán khuôn hàng rào bê tông ly tâm, khuôn hàng rào xi măng thông thường, khuôn con tiện lan can, khuôn con tiện cầu thang xi măng giả gỗ, khuôn cây hương, khuôn con sơn kèo chữ a, khuôn đầu cột, đầu dầm, khuôn mâ Conan tập 100 khi nào phát hành
Conan tập 100 khi nào phát hành Tranh tô màu unicorn cute
Tranh tô màu unicorn cute Trị thâm lỗ hậu môn
Trị thâm lỗ hậu môn Ám địch quả thanh sơn phú thọ
Ám địch quả thanh sơn phú thọ Cách dùng nước hoa johnson baby
Cách dùng nước hoa johnson baby Mùa lựu vào tháng mấy ở việt nam
Mùa lựu vào tháng mấy ở việt nam Khoe ngực trần người nước ngoài rất tự nhiên
Khoe ngực trần người nước ngoài rất tự nhiên Trang trí góc dân gian ở trường mầm non
Trang trí góc dân gian ở trường mầm non Tranh phong cảnh núi rừng
Tranh phong cảnh núi rừng Buffet tôm hùm hà nội
Buffet tôm hùm hà nội Xem phim hoạt hình công chúa tóc mây phần 2
Xem phim hoạt hình công chúa tóc mây phần 2 Lịch thi đấu bóng đá ngoại hạng anh mùa giải 2022/2023
Lịch thi đấu bóng đá ngoại hạng anh mùa giải 2022/2023 Nữ giả nam hiện đại
Nữ giả nam hiện đại Cảnh nóng trong phim titanic
Cảnh nóng trong phim titanic