Giải Bài Tập Hóa Lớp 10 Trong Sgk
Bài 2: Kí hiệu nguyên tử biểu lộ đầy đủ đặc thù cho một nguyên tử của một nhân tố hoá học bởi nó cho biết
A. Số khối A. C. Nguyên tử khối của nguyên tử.
Bạn đang xem: Giải bài tập hóa lớp 10 trong sgk
B. số hiệu nguyên tử z. D. Số khối A và số hiệu nguyên tử z.
Chọn giải đáp đúng.
Chọn D số khối A và số hiệu nguyên tử z.
Bài 3: Nguyên tố cacbon có hai đồng vị :
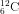
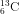
Nguyên tử khối vừa đủ của cacbon là :
A. 12,500; B. 12,011 C. 12,022; D.12,055.
Chọn B. Nguyên tử khối vừa phải của cacbon là: (12 . 98,89 +13 . 1,11)/100 = 12,011
Bài 4: Hãy xác định diện tích phân tử nhân, số proton, số nơtron, số electron, nguyên tử khối của những nguyên tử thuộc các nguyên tố sau:
73Li ; 199F ; 2412Mg ; 4020Ca
Đáp án bài xích 4: Ta có: 73Li mang đến ta biết:
Số năng lượng điện hạt nhân là 3, trong phân tử nhân bao gồm 3 proton, xung quanh vỏ có 3 electron.
Số khối là 7, vậy ta bao gồm số nơtron là:
N = A- Z = 7- 3 = 4.
Nguyên tử khối là 7 (7u).
Tương trường đoản cú ta có: 199F bao gồm Nguyên tử khối là 19 (19u).Số năng lượng điện hạt nhân là 9, trong hạt nhân tất cả 9 proton, quanh đó vỏ tất cả 9 electron.
Số nơtron là 19 – 9 = 10.
2412Mg trongđó:Nguyên tử khồì là 24.
Số điện tích hạt nhân là 12, trong hạt nhân có 12 proton, ngoài vỏ có 12 electron.
Xem thêm: Lỗi Stream Đang Được Xử Lý, Cách Sửa Các Lỗi Thường Gặp Trên Obs
Sô nơtron là 24 – 12 = 12.
4020Ca trong đó :Nguyên tử khối là 40.
Số năng lượng điện hạt nhân là 20, trong hạt nhân có đôi mươi proton, ngoài vỏ có đôi mươi electron.
Số nơtron là: 40 – đôi mươi = 20.
Bài 5 Trang 14 Hóa Đồng gồm hai đồng vị 6529Cu và 6329Cu . Nguyên tử khối vừa đủ của đồng là 63,54. Tính thành phần tỷ lệ của mỗi đồng vị.
Giải bài 5: Gọi a là yếu tắc % của đồng vị 6529Cu; % của đồng vị 6329Cu là 100 – a Ta tất cả :
(a65 + (100-a)63)/100 = 63,54
Giải ra ta được a = 27% 6529Cu. Vậy thành phần 6329Cu là 73%.
Bài 6: Hiđro gồm nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 21H trong 1ml nước (cho rằng trong nước chỉ tất cả đồng vị21H và 11H)? (Cho cân nặng riêng của nước là 1 g/ml).
Giải bài 6:
Gọi % đồng vị 21H là a:
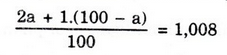
⇒ a = 0,8;
Khối lượng riêng biệt của nước 1 g/ml, vậy 1ml nước có trọng lượng 1g. Trọng lượng mol phân tử của nước là 18g.

Bài 7 Oxi tự nhiên là một hỗn hợp các đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O.
Đáp án và giải bài 7:
Theo tỉ lệ thành phần đề bài bác ta có:

Tỉ lệ mỗi đồng vị O trong hỗn hợp 3 đồng vị:
99,757% 16O => 99757 nguyên tử 16O
0,039% 17O => 39 nguyên tử 17O
0,204% 18O => 204 nguyên tử 18O
Khi gồm một nguyên tử 17O thì số nguyên tử:
16O là: 99,757/0,039 = 2558 nguyên tử.
18O là: 0,204/0,039 = 5 nguyên tử.
Vậy giả dụ như có 1 nguyên tử 17O thì tất cả 2558 nguyên tử 16O và bao gồm 5 nguyên tử 18O.
Bài 8: Agon tách ra từ không khí là láo lếu hợp tía đồng vị : 99,6% 40Ar; 0,063% 38Ar; 0,337% 36Ar. Tính thể tích của 10g Ar ở đk tiêu chuẩn.
Giải bài 8:Nguyên tử khối vừa đủ của argon là:
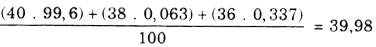
22,4 lít Ar nghỉ ngơi đktc có trọng lượng 39,98 g
x lít Ar ở đktc có cân nặng 10 g
Vì nguyên tử Ar tất cả một nguyên tử nên khối lượng mol phân tử của Ar là 39,98 g. Ở đktc thì 1 mol phân tử Ar hay 39,98g hoàn toàn có thể tích là 22,4l. Vậy 10g Ar có thể tích là 22,4 .10 /39,98 =5,6 (lít)
 Vario màu hồng giá bao nhiêu
Vario màu hồng giá bao nhiêu Áo dài tím huế mặc với quần màu gì
Áo dài tím huế mặc với quần màu gì Trưc tiêp ngoai hang anh
Trưc tiêp ngoai hang anh Bán đĩa cd gốc tại hà nội
Bán đĩa cd gốc tại hà nội Giáo án thơ bé tới trường
Giáo án thơ bé tới trường Xâu kim hay sâu kim
Xâu kim hay sâu kim Đào duy từ hà nội
Đào duy từ hà nội Khi niềm tin đặt nhầm chỗ
Khi niềm tin đặt nhầm chỗ Bảng size áo polo nam
Bảng size áo polo nam Nhất điểu nhì ngư tam xà tứ tượng
Nhất điểu nhì ngư tam xà tứ tượng Danh sách các điểm nhận hàng lazada
Danh sách các điểm nhận hàng lazada Link fb vợ khá bảnh
Link fb vợ khá bảnh Trái nghĩa với chăm chỉ
Trái nghĩa với chăm chỉ Ôn bích hà cấp 3
Ôn bích hà cấp 3 Dàn áo xe vario 125 giá bao nhiều
Dàn áo xe vario 125 giá bao nhiều